Stellungnahme der Deutschen Gesellschaft für Pädiatrische Infektiologie (DGPI), des Berufsverbands der Kinder- und Jugendärzte in Deutschland e.V. (BVKJ), der Deutsche Gesellschaft für Kinder- und Jugendmedizin (DGKJ), und der Deutschen Gesellschaft für Krankenhaushygiene (DGKH)
Teststrategien zur COVID Diagnostik in Schulen
Stand 28.02.2021
Johannes Hübner, Arne Simon, Jörg Dötsch, Reinhard Berner, Hans-Iko Huppertz, Thomas Fischbach, Peter Walger
Kernaussagen:
- Ausgehend von allgemein anerkannten wissenschaftlichen Grundsätzen der Screening- und Infektionsdiagnostik erscheint es angesichts fehlender Daten zur Validität von Antigenschnelltests gerade bei asymptomatischen Kindern zum jetzigen Zeitpunkt weder gerechtfertigt noch angemessen, diese Tests flächendeckend in Schulen und KiTas einzusetzen. Es ist zu erwarten, dass die Zahl falsch negativer und falsch positiver Ergebnisse inakzeptabel hoch sein und weit mehr Schaden als Nutzen mit sich bringen wird. Hinzu kommt das Potenzial großer präanalytischer Fehler in der Probenentnahme.
- Unterschätzt werden die negativen psychologischen Auswirkungen repetitiver Testungen, insbesondere junger Kinder, die entsprechende Konsequenzen wie Quarantäne der eigenen Person oder der Sozialgemeinschaft nach sich ziehen, nicht zuletzt wenn sie möglicherweise aufgrund der invaliden Testmethode wieder aufgehoben werden müssen. Weiterhin besteht die erhebliche Gefahr, dass Testergebnisse negativen Einfluss nehmen werden auf die konsequente Umsetzung der bewährten Hygieneregeln. Dies hat angesichts einer erwartungsgemäß hohen Rate falsch negativer Testergebnisse besonders gravierende Auswirkungen.
- Dies ist umso bedenkenswerter, als bis heute nicht gezeigt ist, dass Infektionsausbrüche in Schulen, die von infizierten Schülern ausgehen, tatsächlich relevant als Motor der Pandemientwicklung wirken. Das RKI hat diese Einschätzung kürzlich in seiner Stellungnahme bestätigt.
- Angesichts der vielfältigen Herausforderungen bezüglich der Interpretation positiver wie negativer Testergebnisse ist eine umfassende Strategie zum Einsatz von SARS-CoV-2 Testungen in Schulen notwendig.
- Wir fordern eine sehr regelmäßige, zum Beispiel zweitägliche Testung des pädagogischen Personals bzw. jedweder erwachsenen Personen, die Kontakt mit den Kindern haben; dies gilt gleichermaßen in Schule wie Hort und Mensa/Kantine, aber auch auf den Schul- bzw. Bring- und Abholwegen.
- Gefordert wird weiterhin eine wissenschaftliche Begleitung von PCR-basierten gepoolten Testverfahren zum Screening in Sentinelschulen.
- Die Teststrategie muss der Bevölkerung und den für die Umsetzung der Maßnahmen zuständigen Personen frühzeitig und umfassend vermittelt werden, um Schaden durch falsch negative (vermehrtes Risikoverhalten) und falsch positive Ereignisse (übermäßig lange Quarantäne mit entsprechenden Folgen) zu verhindern. Auch die langfristige Akzeptabilität der Maßnahme hängt von einer entsprechenden umfassenden Aufklärungs- und Informationskampagne ab.
- Da – abhängig von der Teststrategie und von der Infektionshäufigkeit in der jeweiligen Region – von einem unter Umständen hohen Anteil falsch positiver Ergebnisse unter den positiven Testergebnissen auszugehen ist, bedarf es einer Strategie, welche den betroffenen Personen den Zugang zu spezifischen Bestätigungstests mit Resultaten in weniger als 24 Stunden gewährleistet.
- Um das Risiko falsch-negativer Tests durch nicht sachgemäßen Umgang zu reduzieren, einem problematischen Umgang mit positiven und negativen Testergebnissen durch professionelle Aufklärung entgegenzuwirken und um einen raschen Zugang zu Bestätigungstest zu gewährleisten, sollten Schnelltests nur durch geschultes Personal (z.B. SMAs oder ÄrztInnen) in geeigneten Settings (z.B. Testzentren, Apotheken) angeboten werden. Letzteres spielt für das Gelingen der Teststrategie eine entscheidende Rolle und muss die regionalen Besonderheiten vor Ort berücksichtigen. Hier sollten die entsprechenden Stakeholder auf kommunaler Ebene frühzeitig in die Planung eingebunden werden. Als ressortübergreifend tätige Akteure sind der Öffentliche Gesundheitsdienst (ÖGD) und die niedergelassenen Ärzte hier wichtige Ansprechpartner für die Planung die operative Umsetzung.
- Unabhängige Studien zeigen überdurchschnittlich häufig sehr heterogene Ergebnisse bzgl. der Test-Charakteristika diverser Schnelltests. Ein großflächiger Einsatz von Schnelltests sollte daher nur unter einer engmaschigen wissenschaftlichen Begleitung und Evaluation erfolgen, um unnötigen Schaden infolge eines falschen Sicherheitsgefühls (infolge eines falsch-negativen Testergebnisses) oder infolge unnötiger Isolations- oder Quarantänemaßnahmen (infolge eines falsch-positiven Testergebnisses) von der Bevölkerung abzuhalten.
- Innovative Konzepte basierend auf Pooltestung mittels PCR-basierter Methoden sowie der Verwendung von einfach zu gewinnenden Untersuchungsmaterialien (Speichel, Gurgelwasser etc.) bedürfen einer konsequenten Evaluierung und sind mit nicht unerheblichen logistischen Problemen behaftet.
Anhaltend besteht in der Öffentlichkeit die große Sorge, dass Schulen zu Ausbruchsherden für SARS-CoV-2 Übertragungen werden könnten. Deshalb werden verschiedene Strategien diskutiert, wie Schüler und Lehrer getestet werden können, um Übertragungen in Schulen zu verhindern. Dabei werden vor allem Testungen mittels Antigen-Schnelltesten sowie die Möglichkeit von Pooltestungen erwähnt, um das Probenvolumen und die Kosten unter Kontrolle zu halten.
Von Antigen-Schnelltesten verspricht man sich, möglichst schnell testen zu können, ob man sich mit SARS-CoV-2, dem Erreger von COVID-19, infiziert hat. Um aussagekräftige Ergebnisse zu liefern müssen jedoch gewisse Testkriterien erfüllt sein, die vorab im Rahmen von Studien überprüft wurden. Antigen-Schnelltests sind vergleichsweise simpel in der Anwendung und liefern meist innerhalb weniger Minuten das Testergebnis. Antigen-Schnelltests sind bereits in verschiedenen Ländern im Einsatz und auch in Deutschland wird aktuell über die Zulassung für verschiedene Anwendungsbereiche diskutiert. Hierbei sind neben der praktischen Umsetzbarkeit jedoch auch noch viele Fragen zur epidemiologischen wie bevölkerungsmedizinischen Wirksamkeit ungeklärt. Eine zentrale Frage des aktuellen politischen Diskurses betrifft den Einsatz von Antigen-Schnelltests in Schulen und die damit einhergehende Teststrategie.
Vorteile von Antigen-Schnelltests (ASTs)
- Vergleichsweise einfache Anwendung (durch geschultes medizinisches Personal oder geschulte und ausreichend verständige Laien anwendbar) (1)
- kein Aufwand an spezialisiertem Laborpersonal und Geräten.
- das Ergebnis liegt in 15-30 min vor
- hohe Wahrscheinlichkeit, dass besonders ansteckende Menschen mit hoher Viruslast schnell detektiert werden
Problembereiche von Antigen-Schnelltests (ASTs) im Vergleich zu PCR-basierten Verfahren
- Die Sensitivität ist deutlich niedriger als die der PCR-basierten Testsysteme (NAAT) (2, 3)
- ASTs werden nach einem Konformitätsverfahren durch das Paul-Ehrlich-Institut zugelassen, das zurzeit (Stand 20.02.2021) (3) nicht auf den Ergebnissen unabhängig durchgeführten Validierungsstudien, sondern auf Angaben der Hersteller beruht.
- Ein negativer AST schließt eine SARS-CoV-2 Infektion nicht sicher aus und auch nicht, dass die getestete Person den Erreger übertragen kann (4).
- Ein negatives Testergebnis im AST bedeutet deshalb nicht, dass angemessene Präventionsmaßnahmen überflüssig werden.
- Die Sensitivität ist deutlich niedriger (minimal berichtet: 39%) (5), wenn es sich bei den getesteten Personen um asymptomatische Menschen handelt.
- Fehler bei der Abstrichentnahme (entgegen der Anweisungen der Hersteller) können zusätzlich dazu beitragen, dass die Sensitivität abnimmt.
- Ein negativer AST kann deshalb auch nicht als sicheres Argument dafür genutzt werden, dass eine vormals erkrankte, in Quarantäne oder Isolierung befindliche Person früher als in den entsprechenden Quarantäneverordnungen vorgeschrieben aus der Quarantäne (oder Isolierung) entlassen wird.
Für die Zulassung muss der Hersteller u. a. nachweisen, dass von 100 PCR-positiven Proben nicht selektionierter symptomatischer Patienten mindestens 80 mit dem AST als positiv erkannt werden (Sensitivität ≥ 80%). Diese Vorgaben des BMG und des PEI entsprechen den Lenkungsdokumenten der WHO (6) und der ecdc (7). Die Spezifität der vom PEI zugelassenen ASTs ist mit mindestens 97% grundsätzlich hoch. Trotzdem kommen falsch positive ASTs vor (nach Herstellerangaben bei bis zu 3 von 100 Testungen). Bei niedriger Prätestwahrscheinlichkeit (geringe Rate positiver Teste in der untersuchten Population) und einer sehr hohen Anzahl an Testen kann die absolute Zahl der falsch-positiven Ergebnisse deutlich höher sein, als die der richtig positiven. Jedes positive Ergebnis im AST ist meldepflichtig und bedarf (verpflichtend) (8) einer Bestätigung durch einen NAAT. Ist eine PCR-basierte Testung bei einem AST-positiven Menschen nicht unmittelbar (oder zumindest sehr zeitnah) möglich, werden möglicherweise weitreichende weiterführende Maßnahmen (Quarantäne, Kontaktnachverfolgung etc.) in Gang gesetzt, obwohl der Test falsch positiv ist.
Das Ergebnis des AST ist nur 24 Stunden valide (eine Momentaufnahme) (2, 9). Bei mehrmaliger konsekutiver Testung (zum Beispiel zweimal pro Woche oder an Tag 5 und 6 nach vermuteter oder vermeintlicher Exposition) mit einem AST relativiert sich das Argument der niedrigeren Sensitivität in der frühen Phase einer Infektion (in den ersten 5-7 Tagen) (10, 11).
Vorteile von PCR-basierten Teststrategien (NAATs)
- Beste Sensitivität und Spezifität
- Tests sind in großen Mengen in dafür spezialisierten Labors durchführbar
Problembereich von PCR-basierten Teststrategien
- Testkapazitäten sind begrenzt und werden primär für die klinische Diagnostik benötigt
- Kosten pro Einzeltest machen eine flächendeckende Testung aller Schüler und Lehrer (ca. 12 Mio in Deutschland) in der benötigten Frequenz nicht durchführbar
- Turn-around Zeit (von Abnahme bis zur Übermittlung des Ergebnisses) beträgt bei kommerziellen Labors im besten Fall 24 bis 48h.
- Der logistische Aufwand (Präanalytik, Übermittlung der Ergebnisse etc.) ist groß
- Innovative Konzepte (Pooltestungen, Untersuchung von Speichelproben und anderen Materialien, die einfach von Laien abgenommen werden können) sind vielversprechend, aber noch nicht abschließend Auch hier sind ein erheblicher logistischer Aufwand und die vergleichsweise hohen Kosten zu berücksichtigen.
SARS-CoV-2 Testkriterien für Schulen während der COVID-19 Pandemie
Beim Einsatz von Schnelltests an Schulen muss zwischen den jeweils dahinterstehenden Strategien unterschieden werden:
- Sollen die Tests verhindern, dass infektiöse Schüler*Innen und Lehrer*Innen am Schulgeschehen teilnehmen (d.h. protektives Testen/Screenen)?
- Oder sollen die Tests dazu beitragen, versteckte bzw. bislang unentdeckte Infektionscluster in der Bevölkerung zu identifizieren, um Infektionsketten möglichst frühzeitig zu unterbrechen (d.h. ein populationsbasiertes-Screening)?
Beide Strategien zielen darauf ab, den „Schulbetrieb sicher zu machen“ bzw. diesen schrittweise wieder zu erlauben. Bei Ersterem ist die Strategie eng verknüpft mit der Möglichkeit von Massentestungen im Schulbetrieb zur Sicherstellung des Schulbetriebs. Im zweiten Fall ist die Strategie eng verknüpft mit der engmaschigen Fall- und Kontaktpersonennachverfolgung durch die unteren Gesundheitsbehörden zur Senkung der 7-Tages Inzidenz.
Um zu verstehen, worin sich die beiden Ansätze unterscheiden und welche Limitationen jeweils damit einhergehen, müssen neben dem aktuellen Infektionsgeschehen und dem typischen Infektionsverlauf einer SARS-CoV-2-Infektion auch etwaige Restriktionen der Schnelltests, die sich aus den jeweiligen statistischen Test-Charakteristika ergeben, berücksichtigt werden.
Das Robert Koch-Institut schreibt in seiner Stellungnahme zu Selbsttests (AST und NAAT), dass diese für die Anwendung durch Fachpersonal vorgesehen sind (12). Außerdem geht das Dokument von der Untersuchung von tiefen Nasen-Rachenabstrichen aus. Auch hier wird ausdrücklich darauf hingewiesen, dass ein negatives Testergebnis eine SARS-CoV-2 Infektion nicht ausschließt, sondern allenfalls die Aussage erlaubt, dass der Getestete zum Zeitpunkt der Abnahme weniger wahrscheinlich infektiös ist, wobei die Aussagekraft des Tests zeitlich begrenzt ist.
Strategien zum Einsatz von Antigen-Schnelltests, um zu verhindern, dass Infektionen in die Schule kommen (protektives Testen/Screenen)
Wenn Antigen-Schnelltests eingesetzt werden sollen, um zu verhindern, dass infektiöse Schüler*Innen und Lehrer*Innen am Schulgeschehen teilnehmen, sind folgende Aspekte zu beachten:
- Studien deuten darauf hin, dass eine regelmäßige Testung durch eine frühzeitige Identifikation infizierter Personen die Anzahl von Sekundärinfektion und die Wahrscheinlichkeit von größeren Ausbrüchen deutlich reduzieren könnte (13).
- Da auch von asymptomatischen und präsymptomatischen Personen ein Infektionsrisiko ausgeht, wäre es notwendig, alle Schüler*innen und Lehrer*Innen zu testen.
- Angesichts der begrenzten Sensitivität wird nicht jede infektiöse Person erfasst werden.
- Durch die kurze Gültigkeit von Tests wäre eine tägliche oder zumindest 2 mal wöchentliche Testung aller Personen notwendig, wenn möglichst sicher gegangen werden soll, dass keine infektiöse Person am Schulgeschehen teilnimmt.
- Um zu verhindern, dass gemäß den aktuellen RKI-Empfehlungen ganze Schulklassen nach Entdeckung einer (bestätigten) SARS-Cov-2-Infektion als Kontaktpersonen der Kategorie I in Quarantäne geschickt werden, kann auch bei täglicher Testung nicht auf die Einhaltung der AHA+L Regeln verzichtet werden. Tägliches Testen kann folglich nicht das Einhalten eines Mindestabstands von 1,5m, das Beachten von Hygieneregeln, das Tragen einer (Alltags) Maske und das regelmäßige Lüften von Lehrerzimmern und Klassenräumen ersetzen.
- Bezüglich der praktischen Umsetzung müsste auf die Kooperation aller Eltern und Schüler*Innen zur täglichen und sachgemäßen Durchführung der Tests vertraut werden, oder entsprechende Möglichkeiten in der Schule zur großflächigen Testung von Schüler*Innen angeboten werden.
- Eine tägliche Testung der über 8 Millionen Schüler*Innen und über 750.000 Lehrer*Innen an allgemeinbildenden Schulen mit Antigen-Schnelltests würde mit einem sehr hohen Ressourcenaufwand einhergehen. Selbst bei einem reduzierten Testangebot, bei welchem Schüler*Innen und Lehrer*Innen durchschnittlich zwei Mal pro Woche getestet werden würden, ginge diese Strategie mit einem erheblichen logistischen Aufwand und Ressourceneinsatz einher.
- Es muss von einer vergleichsweise hohen Anzahl falsch positiver Testergebnisse ausgegangen werden, was wiederum mit einem Schulausfall bis zum Eintreffen des Testergebnisses des Bestätigungstests einhergehen könnte.
Zusammenfassend muss der Mehrwert eines protektiven Screeningansatzes zu den aktuell bereits bestehenden Maßnahmen hinsichtlich Nutzen und Schaden abgewogen werden: Hierzu gehören eine insgesamt niedrige Anzahl an Ausbrüchen und eine vergleichsweise niedrige sekundäre Erkrankungsrate an Schulen in Deutschland (14-18) einerseits, sowie ein vergleichsweise hoher Ressourcenbedarf und potentiell erwartbare negative Konsequenzen durch falsch-positive Testergebnisse (z.B. unnötige Freistellung vom Schulbesuch infolge einer Quarantänisierung) sowie falsch-negative Testergebnisse (z.B. erhöhtes Risikoverhalten infolge vermeintlicher Sicherheit) andererseits.
Einsatz von Antigen-Schnelltests als Teil einer populationsbasierten Screening-Strategie
Ein alternativer Einsatz der begrenzten Ressourcen könnte über eine populationsbasierte Screening-Strategie erfolgen. Diese hat zum Ziel, „versteckte“ Infektionen und Cluster zu identifizieren, das heißt Infektionen, deren Ursprung unbekannt ist und die nicht durch Kontaktnachverfolgung bekannter Infektionen identifiziert werden können. Ziel der Strategie ist es durch strategisches Testen unbekannte Infektionsherde zu finden, um dann durch Isolation der Fälle und Quarantänisierung der Kontaktpersonen zu einer rechtzeitigen Unterbrechung von Infektionsketten beizutragen. Antigen-Schnelltests dienen bei dieser Strategie als Erweiterung der Kontaktpersonennachverfolgung – das Verhindern von Infektionen in einem Setting (z.B. einer Schule) stellt hierbei einen positiven Nebeneffekt dar. Durch strategisches Testen mit Fokus auf Personen, die eine erhöhte Wahrscheinlichkeit bieten, infiziert zu sein, kann es gelingen, Infektionen in Hoch-Risiko-Gebieten vergleichsweise rasch zu entdecken.
Eine populationsbasierte Screening-Strategie zielt vor allem auf die Testung von Personen mit einer erhöhten Wahrscheinlichkeit für das Bestehen einer SARS-CoV-2 Infektion ab, beispielsweise Personen mit COVID-19 typischen Symptomen wie Fieber oder ausgeprägtem Husten. Durch wiederholtes Testen (2-3 Mal bis zum Abklingen der Symptome) können infizierte Personen frühzeitig identifiziert und so der Fall- und Kontaktpersonennachverfolgung der unteren Gesundheitsbehörden zugeführt werden.
Durch die geringe Anzahl an Personen im Fokus der Strategie, geht diese mit einem deutlich niedrigeren Ressourceneinsatz einher, als dies bei protektiven Testungs-/Screeningstrategien der Fall ist. Aufgrund der erhöhten Vortestwahrscheinlichkeit infolge des symptomfokussierten Testansatzes reduziert sich zudem das Risiko falsch negativer Testergebnisse.
Innerhalb dieser Strategie würde der Bevölkerung an Testzentren und Institutionen (z.B. Apotheken) die Möglichkeit zum Testen angeboten werden, aber Mitarbeiter*Innen des Gesundheitsdienstes würden durch aufsuchende Testung an Schulen hier Kindern mit Symptomen wie leichtem Husten, Halskratzen etc. eine Testmöglichkeit bieten.
Überblick über den Verlauf einer SARS-Cov-2-Infektion
Nach Infektionsbeginn tritt eine Phase ein, in welcher die infizierte Person weder Krankheitszeichen (Symptome) hat noch infektiös ist – die infizierte Person befindet sich in der sogenannten Latenzzeit . Gegen Ende der Latenzzeit kommt es zu einem deutlichen Anstieg der Viruslast in den Atemwegen, was mit steigender Infektiosität einhergeht. Aufgrund der exponentiellen Virusvermehrung erfolgt der Übergang von der Latenzzeit zur Infektiösität sehr rasch, nach aktueller Datenlage vermutlich innerhalb weniger Stunden (19).
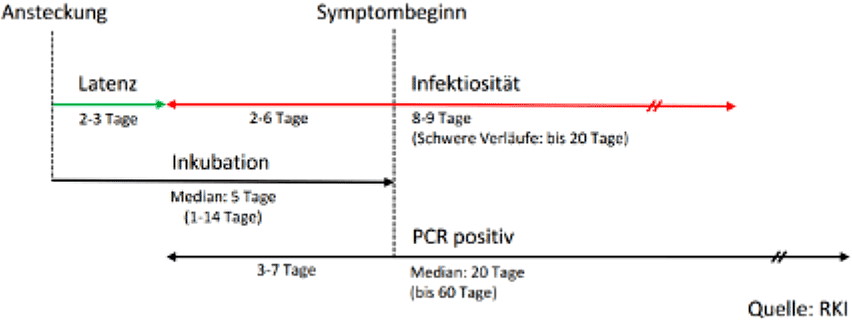
Abbildung 1: Stadien einer SARS-CoV-2 Infektion. Quelle: Albert Magellan; Wikimedia
Bei rund 9 von 10 Erwachsenen verläuft die Infektion symptomatisch und es treten ca. 5 Tage nach Infektion (in den meisten Fällen zwischen 4,5 und 6 Tagen) erste Symptome auf (20) (die so genannte Inkubationszeit). Diese können vergleichsweise schwach ausgeprägt und unspezifisch sein (z. B. Kopf- und Halsschmerzen). Von den symptomatisch Infizierten entwickeln ca. 4 von 5 Erwachsene Fieber, ca. 3 von 5 Erwachsene berichten über Husten (21). Beides gehört auch bei Kindern zu den häufigsten Symptomen und tritt je bei ca. der Hälfte der SARS-CoV-2 infizierten Kinder auf. Der Anteil der Infizierten, welcher eher leicht ausgeprägte oder untypische Symptome aufweist, wie beispielsweise Kopfschmerzen, Erbrechen oder Durchfall, ist bei Kindern häufiger (22, 23).
Etwa die Hälfte aller Infektionen scheint auf eine Ansteckung durch präsymptomatische Personen zu erfolgen. Das heißt, dass die übertragende Person zum Zeitpunkt der Infektion noch asymptomatisch war und COVID-19 Symptome erst im weiteren Verlauf entwickelte. (24-27).
5 bis 14 von 100 Erwachsenen entwickeln über den gesamten Verlauf der Infektion keine Symptome (28), bei Kindern fallen die Zahlen ähnlich aus (11 – 14 %) (22). Auch Personen mit einem asymptomatischen Verlauf können die Infektion weitergeben, das Risiko einer Übertragung ist jedoch niedriger (Relatives Risiko 0,58; 95% KI 0,34 – 0,99) (29).
Überblick über die Charakteristika der Antigen-Schnelltests mit Relevanz für Massentestungen an Schulen
Sensitivität und damit verbunden die Rate von falsch negativen Testergebnissen.
Die Sensitivität eines Tests beschreibt den Anteil infizierter Personen, die bei einer Testung ein positives Testergebnis erhalten. Das Testergebnis ist folglich richtig positiv.
Box 1: Beispiel SensitivitätWeist ein Test eine Sensitivität von 99% auf, werden von 100 infizierten Personen 99 richtig als positiv erkannt. Eine Person erhält fälschlicherweise ein negatives Testergebnis, obwohl sie infiziert ist. Das Testergebnis dieser Person wird als „falsch-negativ“ bezeichnet. |
Das Paul Ehrlich-Institut (PEI) hat in Abstimmung mit dem Robert Koch-Institut (RKI) Mindestkriterien festgelegt, welche ein Antigentest erfüllen muss: Bei einer parallelen Untersuchung von 100 Personen mit Covid-19-Symptomen müssen innerhalb von sieben Tagen nach Symptombeginn über 80% der unselektierten PCR-positiven Proben auch positiv im SARS-CoV-2 Antigenschnelltest ausfallen (Link).
Die Sensitivität der Tests, welche in den Packungen der Produkte und auf der Test-Datenbank des Bundesinstituts für Arzneimittel und Medizinprodukte (BfArM) veröffentlicht sind, beruhen aktuell primär auf Herstellerangaben (Link). Die angegebene Sensitivität der in Deutschland zugelassenen Antigentests reicht von 100,00% bis 80,2%. In unabhängigen Untersuchungen fällt die Sensitivität jedoch deutlich niedriger aus: Beispielsweise wird die Sensitivität des PanbioTM COVID-19 Ag Rapid Test Device von Abbott Rapid Diagnostics Jena GmbH für Nasenabstriche mit 98,1% angegeben und SARS-CoV-2 Rapid Antigen Test Standard Q von SD Biosensor Inc., Roche mit 96,52%. Unabhängige Untersuchungen dieser Tests ermittelten jedoch Sensitivitätswerte (bzw. Übereinstimmungsraten mit PCR-Tests, die häufig zur Schätzung der Sensitivitätswerte von Antigentests herangezogen werden) zwischen 70% und 90%, teilweise ohne Überlappung der Konfidenzintervalle, was die Ergebnisse rein rechnerisch noch einmal unsicherer macht (30-40). Inhaltlich bedeutet das, dass laut diesen Studien zwischen einer aus drei Personen und einer aus zehn Personen, welche mittels eines PCR-Tests positiv auf SARS-CoV-2 getestet wurden, nicht durch einen Antigentest erfasst werden.
Insgesamt gibt es wenige Studien zur Sensitivität und Spezifität von Antigentests bei Kindern. Eine Untersuchung evaluierte den MSD® S-PLEX® CoV-2 N Assay, welcher jedoch nicht in der Test-Datenbank des BfArM gelistet ist. In der Studie wurden Proben von 35 Erwachsenen und 101 Kindern untersucht, welche mittels PCR-Test positiv auf SARS-CoV-2 getestet wurden. Die Sensitivität des Antigentests fiel hier bei den Proben der Kinder niedriger aus (79%; 95% KI: 70-87%) als bei den Erwachsenen (91%; 95% KI: 77-98%) (41).
Selbst bei symptomatischen Personen, deren Infektion mit einem PCR-Test bestätigt wurde, fallen die Antigentests laut unabhängigen wissenschaftlichen Untersuchungen teilweise negativ aus: Bei der Testung von 468 Patient*innen in der Notaufnahme des Katharinenhospitals des Klinikums Stuttgart – 102 davon mit COVID-19 Symptomen – wurde eine Sensitivität von 85,7 % erfasst (n=36 aus 42 PCR-positiven Personen), was einem falsch negativen Testergebnis aus 7 Personen entspricht (37). Bei Untersuchungen der Universitätsklinik Genf von zwei Antigentests mit einmal 529 und einmal 525 Personen traten bei infizierten Patient*Innen mit Fieber und/oder Schüttelfrost bei einer aus 16 PCR-positiven Personen ein falsch negatives Testergebnisse auf (zwischen 1 aus 7 und 1 aus 43 Testresultaten) (32). Bei einer Testung von 1.369 Personen in SARS-CoV-2 Testzentren in Mallorca, Spanien, wiesen 556 mit COVID-19 vereinbare Symptome auf. Bei dieser Untersuchung lag die Sensitivität bei 83,1% – das entspricht einem falsch negativen Testergebnis aus sechs Testungen (33).
Box 2: Sensitivität in Abhängigkeit von der ViruslastBei einer niedrigen Sensitivität (bzw. einer geringen Übereinstimmung mit den Ergebnissen eines parallel erfolgenden PCR-Tests) ist zu beachten, dass der Anteil falsch-positiver Testergebnisse bei Proben mit hohen Viruslasten deutlich höher ausfällt. Da mittels PCR-Test nur die virale RNA nachgewiesen wird und nicht belegt werden kann, dass die gefundenen Viren noch infektiös sind, ist ein SARS-CoV-2-RNA-Nachweis mittels PCR nicht automatisch gleichzusetzen mit Infektiosität oder Ansteckungsfähigkeit einer infizierten Person. Hierzu wird die tatsächlich vorhandene Menge an Virus-RNA, die über den sogenannten Ct-Wert (Cycle-threshold-Wert) ermittelt werden kann, herangezogen. Der Ct-Wert ist ein Maß für die benötigten Schritte zur Vervielfältigung des viralen Erbguts – grob vereinfacht kann man auch sagen, dass der Ct-Wert angibt,l wie lange eine Probe untersucht werden muss, bis das SARS-Cov-2-Erbgut nachgewiesen werden kann. Dabei gilt, je höher der gefundene Ct-Wert, desto niedriger ist die ursprüngliche Viruskonzentration in der untersuchten Probe. Der Ct-Wert steht auch im Zusammenhang mit der Anzahl der Proben, welche in speziellen Viruskulturen angezüchtet werden konnten. Eine Reihe von Studien beschrieben hierbei den Grenzwert für die Möglichkeit, vermehrungsfähige Viren in den Kulturen zu finden, mit ca. 106 Kopien des SARS-CoV-2 Virus pro Milliliter (42-45), wobei andere Studien darauf hinweisen, dass bereits 1.000 funktionsfähige Viren für eine Infektion ausreichen können (46). Eine britische Studie untersuchte den Zusammenhang zwischen dem Ct-Wert und der Möglichkeit, Viren anzuzüchten in 324 positiven Proben. Hierbei kamen die Autor*innen zu dem Schluss, dass 85% mit einem Ct-Wert ≤25 positiv in der Viruskultur ausfielen, 66% mit einem Ct-Wert zwischen >25 und ≤30 und ca. 28% der Proben mit einem Ct-Wert zwischen >30 und ≤35 (s. Tabelle 1). Selbst in den Proben mit einem Ct-Wert von >35 bestand bei 5 aus 60 Proben die Möglichkeit, Viren anzuzüchten – was 8.3% (95% KI: 2,8%–18,4%), entspricht (47). Tabelle 1 – Zusammenhang zwischen dem Ct-Wert und der Möglichkeit, Viren anzuzüchten (n=324 positiven Proben) (47)
Bei der Betrachtung der Ct-Werte ist jedoch zu beachten, dass diese nicht normiert sind und sich von Labor zu Labor unterscheiden können. Zudem sind Ct-Werte vom Ort der Probeentnahme, der Transportdauer sowie dem jeweiligen Testsystem abhängig, was die Vergleichbarkeit der Ergebnisse zusätzlich einschränkt. Während die Sensitivität für niedrige Ct-Werte (<25; d.h. eine hohe Viruslast) in einigen Studien sehr hoch ausfällt und meist der Sensitivität eines PCR-Tests entspricht (es zeigen sich Übereinstimmungsraten zwischen >98% und 100%) (31, 32, 47, 48), fiel sie in anderen Studien zur selben Fragestellung deutlich niedriger aus. Beispielsweise in einer großen Studie mit insgesamt 546 PCR-positiven Personen mit einem CT-Wert <25, bei der die Sensitivität mit 87.9% angegeben wurde (480/546; Test: PanbioTM COVID-19 Ag RADT) (35). Eine Studie mit 315 PCR-positiven Erwachsenen ermittelte für den Ct Wert von ≤26.7 (was einer Virusanzahl von ≤106 SARS-CoV-2 Kopien pro Milliliter entspricht) eine Sensitivität von 95.7% (95%CI: 92.4-97.8%); (Tests: PanbioTM Ag-RDT und Standard Q Ag-RDT) (32). In einer Studie mit 698 PCR-positiven Personen mit einem Ct-Wert <30 wurde eine Sensitivität von 85% (95% CI: 81.6% – 87.1%) ermittelt (Test: PanbioTM Ag- RDT) (35). In einer Studie aus den Niederlanden lag die Sensitivität für CT-Werte <30 bei 92% (92 aus 99 PCR-positiven Personen mit CT-Wert <30; Test: BD Veritor System for Rapid Detection of SARSCoV-2’) (48). Zusammenfassend kann gesagt werden, dass die Antigen-Schnelltests bei hoher bis sehr hoher Viruslast vergleichbare Ergebnisse wie PCR-Tests liefern. Es zeigen sich jedoch große Unterschiede in den Ergebnissen verschiedener Studien, die nicht allein durch Zufallsschwankungen erklärt werden können. Und selbst wenn niedrige CT-Werte ausgeschlossen werden, deuten unabhängige Studienergebnisse darauf hin, dass Antigenschnelltests einen relevanten Anteil infektiöser Personen nicht als solche identifizieren (abhängig von der Studie, etwa zwischen einer Person aus sieben und einer Person aus 20). |
Die zeitliche Dimension der Testung und die zeitliche Gültigkeit der Testergebnisse
Der Zeitpunkt der Testung spielt eine zentrale Rolle für die Aussagekraft der Testergebnisse. In den ersten zwei bis drei Tagen nach einer erfolgten Infektion fallen sowohl PCR-Tests als auch Antigentests nahezu immer falsch negativ aus, da zu diesem Zeitpunkt noch nicht genug virale Kopien in den Atemwegen zu finden sind (49, 50). Eine Ermittlung der Sensitivität der Antigentests durch eine Übereinstimmung mit PCR-Tests überschätzt daher auch systematisch die Sensitivität der Antigentests. Hinzu kommt, dass der Anstieg der Viruslast vor Beginn der Infektiosität exponentiell erfolgt – in einer Größenordnung eher von Stunden als von Tagen (19, 27). Daher besteht praktisch kein bzw. ein nur sehr kurzes Zeitfenster, bei dem Antigentests infizierte Personen vor Beginn ihrer Infektiosität auch als richtig positiv identifizieren können.
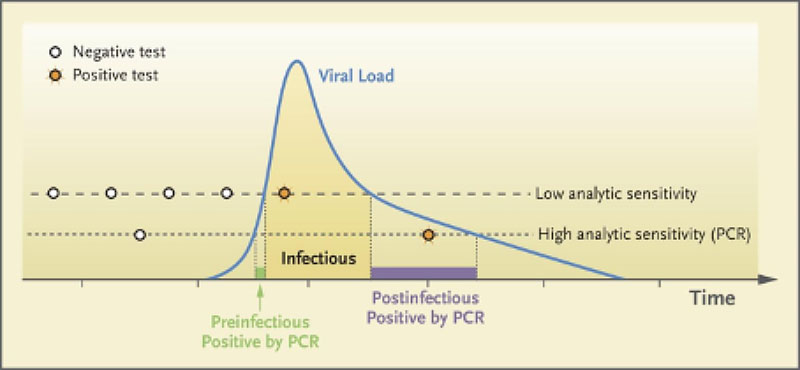
Abbildung 2: Abbildung von Mina et al. zur Entwicklung von Viruslast und Testsensitivität (50).
Des Weiteren ist davon auszugehen, dass die Gültigkeit eines negativen Antigentests nicht länger als einen Tag andauert und nur eine (mindestens) tägliche Testung eine – durch die Sensitivität des Tests begrenzte – Sicherheit dafür bietet, nicht infektiös zu sein.
Spezifität und damit Verbunden der Anteil von falsch negativen Testergebnissen
Die Spezifität eines Tests beschreibt den Anteil nicht infizierter Personen, die bei Testung ein negatives Testergebnis erhalten.
Box 3: Beispiel SpezifizitätWeist ein Test eine Spezifität von 98% auf, werden von 100 Gesunden 98 richtig als gesund erkannt. Zwei Personen erhalten fälschlicherweise ein positives Testergebnis, obwohl sie nicht infiziert sind. Die Testergebnisse dieser zwei Personen werden als „falsch-positiv“ bezeichnet. |
Laut den Mindestkriterien des PEI muss die Spezifität der Antigenschnelltests >97% betragen (Link). Die Herstellerangaben der Tests, welche in der Datenbank des BfArM veröffentlicht sind, reichen bei verschiedenen Tests von einer Spezifität von 100% bis 96,9%. (Link). Wobei auch diese in unabhängigen Untersuchungen oft deutlich niedriger ausfällt (51, 52).
Eine besondere Herausforderung bei der Ermittlung der Spezifität ist, dass bereits geringe Unterschiede in den Prozentwerten (99% gegenüber 99,5%) große Unterschiede in der Betroffenenrate ausmachen können. Studien mit wenigen hundert Teilnehmer*innen haben daher eine vergleichsweise geringe Aussagekraft und die Angabe von einer Spezifität von 100% ist in diesen Studien oft nicht verlässlich oder übertragbar (32, 38, 39).
Eine systematische Übersichtsarbeit ermittelte im August 2020 auf Basis von 13 Evaluationen und insgesamt 2.255 Proben eine Spezifität von 98,9% (95% KI: 97.3% to 99.5%) für mehrere verschiedene kommerzielle Antigen-Schnelltests. Zwei weitere Einzelstudien mit einer Studienpopulation von 4.183 bzw. 1.089 getesteten Personen ermittelten eine Spezifität von 99.1% bzw. 98.9% (35, 53) [Testsysteme: Sofia SARS FIA von Quidel].
Während diese Zahlen aus der Sicht einer einzelnen Person relativ hoch erscheinen, können sie beim Testen einer großen Anzahl von Personen zu einem Problem werden, was durch die falsch-negativ Rate (FNR) – dem Gegenstück zum positiv-prädiktivem Wert (PPW) – ausgedrückt wird. Die FNR entspricht der Wahrscheinlichkeit, bei einem positiven Testergebnis nicht infiziert zu sein. Diese Wahrscheinlichkeit hängt primär von drei Faktoren ab:
- Wie viele Infizierte gibt es in der Population, die ich testen möchte?
- Wie viele davon wird mein Test erfassen (Sensitivität)?
- Wie viele der negativen Personen werden falsch positiv klassifiziert?
Box 4: Beispiel Falsch-negativ Rate (FNR)In Zahlen heißt das: Eine Stadt von 100.000 Personen, in der sich 10 infizierte Personen befinden, wird vollständig getestet. Der Test erfasst 90% der infizierten korrekt (Sensitivität = 90%) und klassifiziert 99,9% aller Personen, die nicht infiziert sind als negativ. Dann werden am Ende 109 positive Testergebnisse vorliegen, von denen 100 (92%) falsch positiv sind. |
Tabelle 1: Falsche-Negativ-Rate von Schnelltests mit verschiedenen Sensitivitäts- und Spezifitätswerten für unterschiedliche Populationen.

Um die FNR möglichst gering zu halten (und damit den PPV möglichst hoch) ist es entscheidend, den Anteil der infizierten Personen in der Gruppe, die getestet werden soll, zu maximieren. Dies lässt sich in der Praxis z.B. dadurch erreichen, indem v.a. Personen mit vergleichsweiser hoher Infektionslast bzw. einer entsprechend hohen Wahrscheinlichkeit hierfür getestet werden, wie es z.B. bei symptomatischen Personen nach einem Risikokontakt der Fall wäre.
Zusammenfassend lässt sich sagen, das selbst Tests mit guten Screening-Eigenschaften, z.B. 90% Sensitivität und 99,5% Spezifität, bei einer geringen Verbreitung des Virus in der zu testenden Bevölkerungsgruppe in den meisten Fällen falsch ausfallen. Bei einer Verbreitung von 10 Infizierten pro 100.000wäre nur eine von insgesamt 55 Personen mit einem positiven Testergebnis wirklich infiziert. Bei asymptomatischen Verläufen fällt der Anteil falsch positiver Testergebnisse noch höher aus, da hier sowohl die Sensitivität der Tests niedriger, als auch deren Vor-Test-Wahrscheinlichkeit für eine Infektion geringer ausfällt.
Spezifität und damit verbunden der Anteil von falsch positiven Testergebnissen
Ein weiterer relevanter Faktor für die Wahl der Teststrategie sowie die damit einhergehende Evaluation etwaiger Konsequenzen ist der sogenannte negative prädiktive Wert (NPW). Der NPW gibt an, wie zuversichtlich eine Person sein kann, dass sie bei einem negativen Testergebnisse auch wirklich nicht infiziert ist. Auch hier spielt die Verbreitung von SARS-CoV-2 in der Bevölkerung und die Sensitivität des Tests eine wichtige Rolle.
Box 5: Beispiel negativ-prädiktiver Wert (NPW)Wenn in einer Bevölkerung von 100.000 Personen sich 10 nicht-identifizierte infizierte Personen befinden, und eine zufällige Person herausgegriffen wird, ist deren Wahrscheinlichkeit nicht infiziert zu sein 99,99% (999.990/100.000). Wenn diese Person mit einem Test mit einer Sensitivität von 80% und einer Spezifität von 99,5% getestet wird und das Testergebnis negativ ausfällt, kann aus dem Verhältnis von falsch negativen Testergebnissen (2/10) und den korrekt negativen Testergebnissen (99.490 / 99.990) berechnet werden, dass die Person bei einem negativen Testergebnis zu 99,998% nicht mit SARS-CoV-2 infiziert ist. |
Zusammenfassung zu Test-Charakteristika
Die Antigen-Schnelltests haben keine ausreichende Sensitivität, um einen sicheren Ausschluss einer Infektion zu gewährleisten. Durch den diagnostisch blinden Fleck in den Tagen direkt nach einer Infektion und aufgrund der sehr raschen Virusvermehrung vor Beginn der eigentlichen Infektiosität ist die Aussagekraft eines Testergebnisses nicht länger als ein Tag gültig. Angesichts der Test-Charakteristika der sich aktuell auf dem Markt befindlichen Antigentests ist beim Einsatz in Populationen mit einer geringen Verbreitung des Virus (d.h. einer niedrigen Vortest-Wahrscheinlichkeit) davon auszugehen, dass ein positives Testergebnis mittels Antigen-Schnelltest bei der darauf folgenden PCR-Testung in den allermeisten Fällen negativ ausfallen wird. Dies führt für Einzelpersonen dazu, dass sowohl negative als auch positive Testergebnisse keine verlässliche Aussage bieten.
Bei Ausweitung der Antigen-Schnelltests auf Selbstanwendung ist eine professionelle Bewertung des Testergebnisses nicht gewährleistet. Stattdessen ist damit zu rechnen, dass die Interpretation eines negativen Tests durch Laien zur Annahme führen wird, dass die getestete Person nicht infiziert und damit auch nicht ansteckend sei. Mit hoher Wahrscheinlichkeit wird diese Fehlbewertung zu Vernachlässigungen der Hygieneschutzmaßnahmen führen, wodurch der erhoffte Nutzen durch Früherkennung hochinfektiöser Personen konterkariert wird. Auch die Annahme, dass ein positives Testergebnis die getestete Person verantwortungsvoll zur Bestätigung durch einen PCR-Test und damit zur eventuellen Einleitung einer mindestens 10-tägigen Isolation veranlasst, kann nur vermutet werden.
Ohne eine professionelle Testbegleitung in Bezug auf Durchführung, Interpretation des Ergebnisses und Veranlassung der Konsequenzen muss mit einer hohen Rate an Qualitätseinbußen gerechnet werden.
Die Autoren danken Herrn Jan Stratil (Mitarbeiter des Lehrstuhls für Public Health und Versorgungsforschung der LMU München) für Hilfe und Unterstützung bei der Abfassung dieser Stellungnahme.
Referenzen
- Lindner A, Nikolai O, Rohardt C, Kausch F, Wintel M, Gertler M, et al. SARS-CoV-2 patient self-testing with an antigen-detecting rapid test: a head-to-head comparison with professional testing. medRxiv preprint. 2021; https://www.medrxiv.org/content/10.1101/2021.01.06.20249009v1.supplementary-material Posted January 08, 2021.).
- Bundesweites Forschungsnetz angewandte surveillance und testung (B-FAST). Positionspapier des Netzwerk B-FAST im Nationalen Forschungsnetzwerk der Universitätsmedizin zu COVID-19 zur Anwendung und Zulassungspraxis von Antigen-Schnelltests zum Nachweis des neuen Coronavirus, SARS-CoV-2. http://num-bfast.uni-goettingen.de/wp-content/uploads/2021/01/Positionspapier_SARS-CoV-2-Ag-Tests.pdf. 2021;2021-01-05.
- Paul-Ehrlich-Institut. Mindestkriterien für SARS-CoV-2 Antigentests im Sinne von § 1 Abs. 1 Satz 1 TestVO: Antigenschnelltests. https://www.pei.de/SharedDocs/Downloads/DE/newsroom/dossiers/mindestkriterien-sars-cov-2-antigentests.pdf?__blob=publicationFile&v=9 (zuletzt aufgerufen am 20022021). 2021;15.01.2021.
- Robert Koch Institut (Berlin). Hinweise zur Testung von Patienten auf Infektion mit dem neuartigen Coronavirus SARS-CoV-2: Antigenteste. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Vorl_Testung_nCoV.html. 2020;Stand: 12.2.2021.
- Paul G, Plecko T, Sethi S, Schilling T, Wienand O, Jürgensen J, et al. Klinische Performance eines neuen SARS-CoV-2-AntigenTests in der Notaufnahme eines Maximalversorgers. Epidemiol Bulletin des Robert Koch-Instituts, Berlin. 2021;https://www.rki.de/DE/Content/Infekt/EpidBull/Archiv/2021/Ausgaben/03_21.pdf;jsessionid=51E288EDE348AB67CAD6C36516595252.internet092?__blob=publicationFile(3):13-8.
- World Health Organization. COVID-19: Laboratory and diagnosis Interim guidance: Antigen-detection in the diagnosis of SARS-CoV-2 infection using rapid immunoassays. https://www.who.int/publications/i/item/antigen-detection-in-the-diagnosis-of-sars-cov-2infection-using-rapid-immunoassays. 2020;11 September 2020.
- European Centre for Disease Prevention and Control (ecdc). Technical Report: Options for the use of rapid antigen tests for COVID-19 in the EU/EEA and the UK. https://www.ecdc.europa.eu/sites/default/files/documents/Options-use-of-rapid-antigen-tests-for-COVID-19_0.pdf. 2021;19 Nov 2020.
- Bundesministerium für Gesundheit. Verordnung zum Anspruch auf bestimmte Testungen für den Nachweis des Vorliegens einer Infektion mit dem Coronavirus SARS-CoV-2. https://www.bundesgesundheitsministerium.de/fileadmin/Dateien/3_Downloads/C/Coronavirus/Corona-Test-VO_20i_SGB_V_mit_Begruendung.pdf. 2020;Bearbeitungsstand: 08.06.2020 18:12 Uhr.
- Rissland J, Simon A. Rationaler und effektiver Umgang mit der SARS-CoV-2 Diagnostik. Hygiene & Medizin. 2021;46(1-2):D28-D33.
- Mina MJ, Parker R, Larremore DB. Rethinking Covid-19 Test Sensitivity – A Strategy for Containment. N Engl J Med. 2020;in press.
- Sax P. Does the White House Outbreak Invalidate the Strategy of Frequent Testing for COVID-19 Control? BLOG NEJM Journal Watch. 2020;October 4th, 2020(https://blogs.jwatch.org/hiv-id-observations/index.php/does-the-white-house-outbreak-invalidate-the-strategy-of-frequent-testing-for-covid-19-control/2020/10/04/).
- Robert Koch Institut (Berlin). SARS-CoV-2 Testkriterien für Schulen während der COVID-19 Pandemie – Empfehlungen des Robert Koch-Instituts für Schulen. https://www.rki.de/DE/Content/InfAZ/N/Neuartiges_Coronavirus/Teststrategie/Testkriterien-Schulen.pdf?__blob=publicationFile. 2021;18.02.2021.
- Paltiel AD, Zheng A, Walensky RP. Assessment of SARS-CoV-2 Screening Strategies to Permit the Safe Reopening of College Campuses in the United States. JAMA network open. 2020;3(7):e2016818-e.
- European Centre for Disease Prevention and Control E. COVID-19 in children and the role of school settings in transmission – first update. 23 December 2020. Stockholm: ECDC; 2020.
- Hoch M, Vogel S, Kolberg L, Dick E, Fingerle V, Eberle U, et al. Weekly SARS-CoV-2 sentinel in primary schools, kindergartens and nurseries, June to November 2020, Germany. 2021:2021.01.22.21249971.
- Institut für Hygiene und Infektionsschutz Landau. Secondary Attack Rate in Schools Surveillance, RLP (SARS-S) Koblenz: Landesuntersuchungsamt Rheinland-Pfalz 2020.
- Larosa E, Djuric O, Cassinadri M, Cilloni S, Bisaccia E, Vicentini M, et al. Secondary transmission of COVID-19 in preschool and school settings in northern Italy after their reopening in September 2020: a population-based study. 2020;25(49):2001911.
- Otte im Kampe E, Lehfeld A-S, Buda S, Buchholz U, Haas W. Surveillance of COVID-19 school outbreaks, Germany, March to August 2020. 2020;25(38):1–6.
- Smith AM, Perelson AS. Influenza A virus infection kinetics: quantitative data and models. 2011;3(4):429-45.
- Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Annals of internal medicine. 2020;172(9):577-82.
- Grant MC, Geoghegan L, Arbyn M, Mohammed Z, McGuinness L, Clarke EL, et al. The prevalence of symptoms in 24,410 adults infected by the novel coronavirus (SARS-CoV-2; COVID-19): A systematic review and meta-analysis of 148 studies from 9 countries. PloS one. 2020;15(6):e0234765-e.
- Badal S, Thapa Bajgain K, Badal S, Thapa R, Bajgain BB, Santana MJ. Prevalence, clinical characteristics, and outcomes of pediatric COVID-19: A systematic review and meta-analysis. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. 2021;135:104715.
- Viner RM, Ward JL, Hudson LD, Ashe M, Patel SV, Hargreaves D, et al. Systematic review of reviews of symptoms and signs of COVID-19 in children and adolescents. 2020:archdischild-2020-320972.
- Arons MM, Hatfield KM, Reddy SC, Kimball A, James A, Jacobs JR, et al. Presymptomatic SARS-CoV-2 Infections and Transmission in a Skilled Nursing Facility. 2020;382(22):2081-90.
- Ferretti L, Wymant C, Kendall M, Zhao L, Nurtay A, Abeler-Dörner L, et al. Quantifying SARS-CoV-2 transmission suggests epidemic control with digital contact tracing. 2020;368(6491):eabb6936.
- Ganyani T, Kremer C, Chen D, Torneri A, Faes C, Wallinga J, et al. Estimating the generation interval for coronavirus disease (COVID-19) based on symptom onset data, March 2020. 2020;25(17):2000257.
- He X, Lau EHY, Wu P, Deng X, Wang J, Hao X, et al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nature Medicine. 2020;26(5):672-5.
- Chen C, Zhu C, Yan D, Liu H, Li D, Zhou Y, et al. The epidemiological and radiographical characteristics of asymptomatic infections with the novel coronavirus (<em>COVID-19</em>): A systematic review and meta-analysis. International Journal of Infectious Diseases. 2021;104:458-64.
- Byambasuren O, Cardona M, Bell K, Clark J, McLaws M-L, Glasziou P. Estimating the extent of asymptomatic COVID-19 and its potential for community transmission: Systematic review and meta-analysis. Official Journal of the Association of Medical Microbiology and Infectious Disease Canada. 2020;5(4):223-34.
- Albert E, Torres I, Bueno F, Huntley D, Molla E, Fernández-Fuentes MÁ, et al. Field evaluation of a rapid antigen test (Panbio™ COVID-19 Ag Rapid Test Device) for COVID-19 diagnosis in primary healthcare centres. Clinical Microbiology and Infection.
- Alemany A, Baró B, Ouchi D, Rodó P, Ubals M, Corbacho-Monné M, et al. Analytical and clinical performance of the panbio COVID-19 antigen-detecting rapid diagnostic test. Journal of Infection.
- Berger A, Ngo Nsoga MT, Perez-Rodriguez FJ, Aad YA, Sattonnet-Roche P, Gayet-Ageron A, et al. Diagnostic accuracy of two commercial SARS-CoV-2 Antigen-detecting rapid tests at the point of care in community-based testing centers. 2020:2020.11.20.20235341.
- Bulilete O, Lorente P, Leiva A, Carandell E, Oliver A, Rojo E, et al. Evaluation of the Panbio™ rapid antigen test for SARS-CoV-2 in primary health care centers and test sites. 2020:2020.11.13.20231316.
- Linares M, Pérez-Tanoira R, Carrero A, Romanyk J, Pérez-García F, Gómez-Herruz P, et al. Panbio antigen rapid test is reliable to diagnose SARS-CoV-2 infection in the first 7 days after the onset of symptoms. Journal of Clinical Virology. 2020;133:104659.
- Abdulrahman A, Mustafa F, AlAwadhi AI, Alansari Q, AlAlawi B, AlQahtani M. Comparison of SARS-COV-2 nasal antigen test to nasopharyngeal RT-PCR in mildly symptomatic patients. 2020:2020.11.10.20228973.
- Cerutti F, Burdino E, Milia MG, Allice T, Gregori G, Bruzzone B, et al. Urgent need of rapid tests for SARS CoV-2 antigen detection: Evaluation of the SD-Biosensor antigen test for SARS-CoV-2. Journal of clinical virology : the official publication of the Pan American Society for Clinical Virology. 2020;132:104654.
- Paul G, Plecko T, Sethi S, Schilling T, Wienand O, Jürgensen JS, et al. Klinische Performance eines neuen SARS-CoV-2-AntigenTests in der Notaufnahme eines Maximalversorgers. Epidemiologisches Bulletin. 2021(3):10-5.
- Iglὁi Z, Velzing J, van Beek J, van de Vijver D, Aron G, Ensing R, et al. Clinical evaluation of the Roche/SD Biosensor rapid antigen test with symptomatic, non-hospitalized patients in a municipal health service drive-through testing site. 2020:2020.11.18.20234104.
- Schwob JM, Miauton A, Petrovic D, Perdrix J, Senn N, Jaton K, et al. Antigen rapid tests, nasopharyngeal PCR and saliva PCR to detect SARS-CoV-2: a prospective comparative clinical trial. 2020:2020.11.23.20237057.
- Krüger LJ, Gaeddert M, Tobian F, Lainati F, Gottschalk C, Klein JAF, et al. Evaluation of the accuracy and ease-of-use of Abbott PanBio – A WHO emergency use listed, rapid, antigen-detecting point-of-care diagnostic test for <em>SARS-CoV-2</em>. 2020:2020.11.27.20239699.
- Pollock NR, Savage TJ, Wardell H, Lee RA, Mathew A, Stengelin M, et al. Correlation of SARS-CoV-2 nucleocapsid antigen and RNA concentrations in nasopharyngeal samples from children and adults using an ultrasensitive and quantitative antigen assay. 2021:JCM.03077-20.
- Wölfel R, Corman VM, Guggemos W, Seilmaier M, Zange S, Müller MA, et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020;581(7809):465-9.
- Huang C-G, Lee K-M, Hsiao M-J, Yang S-L, Huang P-N, Gong Y-N, et al. Culture-Based Virus Isolation To Evaluate Potential Infectivity of Clinical Specimens Tested for COVID-19. 2020;58(8):e01068-20.
- Bullard J, Dust K, Funk D, Strong JE, Alexander D, Garnett L, et al. Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples. Clinical Infectious Diseases. 2020;71(10):2663-6.
- Pekosz A, Cooper CK, Parvu V, Li M, Andrews JC, Manabe YC, et al. Antigen-based testing but not real-time PCR correlates with SARS-CoV-2 virus culture. 2020:2020.10.02.20205708.
- Popa A, Genger JW, Nicholson MD, Penz T, Schmid D, Aberle SW, et al. Genomic epidemiology of superspreading events in Austria reveals mutational dynamics and transmission properties of SARS-CoV-2. Science translational medicine. 2020;12(573).
- Singanayagam A, Patel M, Charlett A, Lopez Bernal J, Saliba V, Ellis J, et al. Duration of infectiousness and correlation with RT-PCR cycle threshold values in cases of COVID-19, England, January to May 2020. Euro surveillance : bulletin Europeen sur les maladies transmissibles = European communicable disease bulletin. 2020;25(32).
- Van der Moeren N, Zwart VF, Lodder EB, Van den Bijllaardt W, Van Esch HRJM, Stohr JJJM, et al. PERFORMANCE EVALUATION OF A SARS-COV-2 RAPID ANTIGENTEST: TEST PERFORMANCE IN THE COMMUNITY IN THE NETHERLANDS. 2020:2020.10.19.20215202.
- Kucirka LM, Lauer SA, Laeyendecker O, Boon D, Lessler J. Variation in False-Negative Rate of Reverse Transcriptase Polymerase Chain Reaction-Based SARS-CoV-2 Tests by Time Since Exposure. Annals of internal medicine. 2020;173(4):262-7.
- Mina MJ, Parker R, Larremore DB. Rethinking Covid-19 Test Sensitivity — A Strategy for Containment. 2020;383(22):e120.
- Corman VM, Haage VC, Bleicker T, Schmidt ML, Mühlemann B, Zuchowski M, et al. Comparison of seven commercial SARS-CoV-2 rapid Point-of-Care Antigen tests. 2020:2020.11.12.20230292.
- Dinnes J, Deeks JJ, Adriano A, Berhane S, Davenport C, Dittrich S, et al. Rapid, point-of-care antigen and molecular-based tests for diagnosis of SARS-CoV-2 infection. The Cochrane database of systematic reviews. 2020;8:Cd013705.
- Pray IW, Ford L, Cole D, Lee C, Bigouette JP, Abedi GR, et al. Performance of an Antigen-Based Test for Asymptomatic and Symptomatic SARS-CoV-2 Testing at Two University Campuses – Wisconsin, September-October 2020. MMWR Morbidity and mortality weekly report. 2021;69(5152):1642-7.




